Während die Normenreihe DIN EN ISO 9000ff den kontinuierlichen Verbesserungsprozess (KVP) und die Kundenzufriedenheit in den Vordergrund stellt, konzentriert sich die DIN EN ISO 13485:2016 im Kern auf die Gewährleistung der Produktsicherheit. Dies ergibt sich aus der Anwendung der Norm für den Medizinproduktebereich, in welchem die möglichen Auswirkungen von Produktmängeln auf Anwender und Patienten gravierend sein können. Besonderer Wert wurde daher bei der aktuellen Fassung auf die Aspekte Risikomanagement und Produktverfolgbarkeit (traceability) gelegt. Ebenso sind die Bereiche Software als Medizinprodukt und als Zubehör für Medizinprodukte stärker beleuchtet worden als noch in den Vorgängerversionen. Die Hauptunterschiede zur ISO 9001 sind somit:
- Kontrolle der Arbeitsumgebung in Hinblick auf Produktsicherheit
- Risikomanagement
- Anforderungen an die Dokumentation und Validierung für sterile Medizinprodukte
- Rückverfolgbarkeit
- Harmonisierung mit vorherigen EU-Richtlinien (93/42/EWG (MDD)), 90/385/EWG, 98/79/EG (IVDD))
- Angestrebte Harmonisierung mit der EU Verordnung 2017/745 (MDR) und 2017/46 (IVDR)
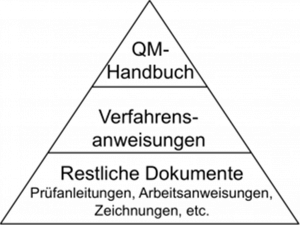
Das Qualitätsmanagement ist pyramidenförmig aufgebaut. An oberster Stelle steht dabei das Qualitätsmanagement Handbuch, welches die grundsätzlichen Regelungen beinhaltet. Die Mitte der Pyramide bilden Verfahrens- und Arbeitsanweisungen, die die Regelungen detaillierter beschreiben. Abschließend bilden Aufzeichnungen in Form von Formblättern die Basis der Pyramide.
